9月4日,国家卫健委官网发布了对第7870号全国人大代表建议的正式答复,明确将细胞治疗定位为国际医学前沿的重点发展领域。答复不仅进一步明确了干细胞研究与应用的合规路径,更从立法与监管、区域试点、数据协同、监管科学等多个层面,为我国干细胞产业的长远健康发展铺就“制度基石”。
一、立法与监管持续完善,推动行业规范发展
答复强调,干细胞研究必须在合规框架下推进。《干细胞临床研究管理办法》等相关法规明确,完成备案机构的临床研究后,干细胞制剂的研究成果可用于药品注册申报。
更值得关注的是,国家正联手司法部推进《生物医学新技术临床研究和临床转化应用管理条例》,该条例已被纳入国务院2025年度立法计划,将为细胞治疗的研究与转化提供更强法律保障。
登记备案系统也在不断优化,流程更便捷,监管更严密。国家药监局已制定近二十项细胞治疗相关指导原则,全面接轨国际标准,实现从研发、核查、审评到上市后监管的全流程覆盖,真正做到对每一家企业“无死角”巡查。

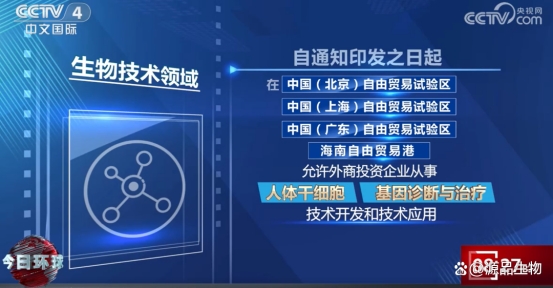
二、“区域试点”政策落地,开放创新步伐加快
政策明确支持北京、上海、广东自贸试验区及海南自由贸易港率先开展细胞治疗等相关技术开发与应用的试点,并欢迎外资企业参与。
这些区域试点致力于推动产品注册与生产,一旦产品获批上市,便可在全国范围内推广。2025年即将推出的《稳外资行动方案》也明确提出,要推进试点地区政策落地,并适时扩大开放区域,进一步激活创新资源。
三、数据协同成为新动力,推动产学研医深度融合
数据正成为推动医疗产业发展的新要素。国家已启动《全国医疗卫生机构信息互通共享三年攻坚行动》,加速医疗系统数字化转型。
同时,《“数据要素×”三年行动计划》也在积极推进,推动建立行业公共数据登记与可信数据空间。

通过“干细胞研究与器官修复”等重点专项,国家正大力推动企业、高校、科研机构与医疗机构协同合作,集中突破重大科学问题与关键技术,促进示范应用落地。干细胞临床与转化不再是“单打独斗”,而是迈入“共享数据+协同创新”的新阶段。
四、监管科学强化,为安全与创新“双护航”
监管不仅“严格”,更要“科学”。国家在重点研发专项中专门设立“干细胞及其衍生物创新药物监管技术研究”项目,加强监管科学方法与工具的研究。
药监局也将“干细胞和基因治疗产品评价体系与方法研究”纳入药品监管科学行动计划,重点关注非临床评价工具、临床试验设计及新标准开发。
通过这些前沿布局,未来干细胞产品的评价体系将更加科学、可重复、可比较,在保障安全性的同时,大幅提升审批效率。
总结:干细胞行业正迎来制度化、规范化发展的新时代
卫健委的这次答复,清晰描绘出干细胞与细胞治疗领域的高质量发展路径:
法律制度不断完善,研发与转化有据可依;
区域试点持续扩大,为创新技术提供试验田与推广平台;
数据共享加速推进,真实世界证据成为产业发展新引擎;
监管科学持续强化,为安全与创新保驾护航。
干细胞产业正在从“可以做”走向“做得更稳、更好、更长远”。对企业与科研机构而言,合规与质量已成为核心竞争力;对患者和公众来说,一个更加透明、安全、可及的细胞治疗时代,正在到来。
信息来源:国家卫生健康委员会